Concepto
La Retinopatía del Prematuro (ROP) es una enfermedad que ocurre en los bebés prematuros y de bajo peso, donde se produce un desarrollo anormal de los vasos que irrigan la retina, que es la membrana que tapiza el interior del globo ocular.
Es una retinopatía vasoproliferativa donde hay una detención del crecimiento vascular, y luego una anormal maduración de los mismos.
El desarrollo normal de la vascularización de la retina
El desarrollo vascular de la retina se produce a partir de las 16 semanas de gestación, desde un tallo mensenquimático en el nervio óptico hacia la periferia, y va progresando mes a mes como lo demuestra la figura 1.
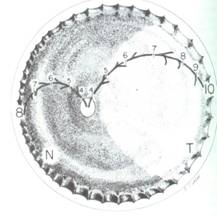
fig 1 : Esquema del desarrollo vascular de la retina, dado por los meses de gestación , obsérvese que del lado nasal se completa antes que la del lado temporal del ojo
Como el nervio óptico no está ubicado al centro del ojo, sino hacia la zona nasal, de ese lado se competa la vascularización aproximadamente a los 8 meses de gestación, no así en el lado temporal que se completa entre los 9 ½ y 10 meses.
Por lo tanto cuanto más prematuros son los bebes, dependiendo de cuántas semanas antes de lo previsto haya nacido, vamos a encontrar su desarrollo vascular más incipiente, y mayor superficie de retina va a quedar por vascularizar.
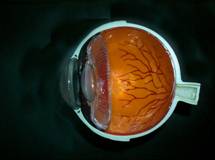
Fig: 2 esquema de la anatomía de un ojo donde se observa que los vasos retinianos no han llegado ha completar la vascularización hasta la pars plana
La enfermedad fue descripta por 1ra vez en 1942 por Terry como Fibroplasia Retrolental
La primera gran epidemia de niños ciegos fue entre el 48 -52. En la década del 50 se la relacionó por primera vez con el oxígeno, lo que llevó a un control estricto del mismo, restringiendo su uso en las unidades de cuidado neonatal de EEUU. Esto provocó una disminución brusca de la incidencia de ROP en prematuros, pero aumentó drásticamente el daño cerebral severo y las muertes en bebés prematuros. Se estimó que, en esa época, por cada caso que se previno de ROP al disminuir el uso de oxígeno, murieron 16 niños prematuros.
La Segunda Gran Epidemia se produce en los años 70 a 80, porque los avances técnicos y científicos aumentaron la sobrevida de prematuros más pequeños y de más bajo peso.
En el año 80 se decide nombrarla “Retinopatía del Prematuro”, y dejar el nombre de Fibroplasia Retrolental para los estadios cicatrizales.
Día a día la neonatología avanza y la tecnología mejora el cuidado y aumenta mucho la sobrevida de los bebes prematuros, lo que determina que vamos a encontrar más bebés con desarrollos vasculares retinianos más incompletos.

Fig 3. Bebé en incubadora Fig: 4 Bebé con aporte de O2 suplementario
Epidemiología y Demografía
Entre 1943 y 1951, fueron 7000 niños prematuros ciegos en EEUU por ROP. En un solo año (1979) hubieron 546 niños prematuros ciegos, y hoy por año hay unos 500 nuevos niños ciegos por ROP en EEUU.
La sobrevida de un prematuro de 1000 grs. aumentó considerablemente con los adelantos técnicos y médicos,siendo en:
-1950 sobrevida del 8%
-1980 sobrevida del 35%
-1999 sobrevida del 90% (según las terapias)
Hoy en día un bebé de 25-26 semanas de gestación y de 750 grs. tiene una sobrevida del 50%.
• Prematurez (Edad Gestacional)
• Bajo Peso
• Oxígeno
• Distress Respiratorio
• Hipoxia Severa
• Ductus Permeable
• Hemorragia Cerebral
• Infecciones
• Transfusiones
Tres son los factores más importantes: peso, edad gestacional y el oxígeno
· Peso:
El peso está estrechamente relacionado a la presencia de ROP.
Cuanto más bajo peso, mayores posibilidades de presentar algún grado de ROP.
Es inversamente proporcional
- peso menor de 1000g: incidencia mayor al 50 %
- peso mayor de 1500g: incidencia menor al 15 al 20 %
Fig 5: Bebé de bajo peso , obsérvese que ocupa las palmas de las manos
Prevalencia del ROP (según peso) en EEUU
|
Peso de nacimiento |
ROP II |
ROP IV |
Ceguera |
|
menos de 1000 grs |
38 - 54% |
22-44% |
5-11% |
|
1000 a 1500 grs |
5-15% |
0.7-7% |
0.3-1.1% |
|
más de 1500 grs |
0.6-3% |
0.2% |
0% |
Ophthlmology 1991 Nov;98(11):1628-40 CryoROP Group
Resumiendo: un bebé prematuro que pesa 1000 gr o menor va tener aproximadamente un 50% de posibilidades de tener algún grado de ROP y un 10% de posiblidades de ceguera.
· Edad Gestacional
La misma se cuenta en “semanas de gestación”, y también es inversamente proporcional: cuanto más tiempo antes de la fecha prevista o de menor edad gestacional haya nacido el bebé, mayor es la posibilidad de presentar algún grado de ROP.
Fig 6: foto de bebé (intrauterino)
“Por cada semana más que el Bebé permanece en el útero, disminuyen en un 27% las probabilidades de tener ROP Severa”.
(AAO Meeting 1996- Dres S Isenber y Earl Palmer)
· Oxígeno
El oxígeno fue indicado desde hace mucho tiempo como el culpable de esta enfermedad (año 50). Sin embargo, el aporte de oxígeno inspirado es un aliado fundamental para salvar la vida y la función cerebral del bebé prematuro, que por su inmadurez pulmonar no puede obtenerlo adecuadamente.
El oxígeno cumple un rol importante en la génesis de ROP, pero no es el único responsable; tanto su falta (HIPOXIA) como su exceso (HIPEROXIA), van a desencadenar una cascada de eventos que llevan a la retinopatía.
Hay 3 puntos importantes
• Hiperoxia
• las fluctuaciones Hipoxia/ Hiperoxia
• Monitoreo del la PO2 con oximetría es fundamental !
Fig 7: Prematuros en incubadora, con oxímetros conectados
Está demostrado es que a mayor tiempo de oxigenoterapia sin control oximétrico y a mayor concentración de oxígeno inspirado, mayores son las posibilidades de ROP. El OXIGENO en exceso frena el desarrollo vascular, y así comienzan a desencadenarse los estímulos para el proceso de ROP.
Lo que sí esta claro, es que esta hipoxias e hiperoxias producen 2 fases bien definidas
• Fase Obliterativa
El estímulo normal más importante para el crecimiento vascular de la retina es la Hipoxia fisiológica de la retina periferica.
El bebé al recibir suplemento de oxígeno (Hiperoxia) frena el desarrollo normal de la vasculogénesis retiniana al suspenderse la liberación de factores de crecimiento endotelial (VEGF), y deteniendo así la formación de nuevos vasos
Al mismo tiempo siguen creciendo y diferenciándose las capas de la retina, pero ésto no es acompañado por la onda de crecimiento vascular, que se detuvo por el exceso de oxígeno.
Cuando se suspende el suplemento de oxígeno por haber logrado el bebé mejor función respiratoria, comienza la siguiente fase.
• Fase vasoproliferativa (VFGH)
Cuando el bebé deja de recibir aporte extra de oxígeno, se encuentra con una zona de retina periférica sin vasos donde no alcanza la oxigenación, es decir con gran cantidad de retina hipóxica.
Esta hipoxia retiniana produce la fase vasoproliferativa, regida en su mayor parte por el Factor de cremiento endotelial o VEGF. Sería el mismo proceso que en toda patología que hay retina isquémica o hipóxica como por ejemplo en la retinopatía diabética o en una trombosis de vena retinal isquémica
Aquí la retina del bebe descubre el engaño de haber estado en una “Luna de Miel con el Oxígeno”.
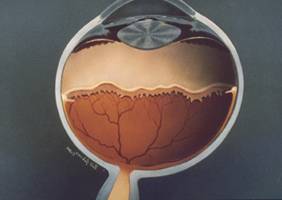

fig 8 la zona posterior está irrigada y la zona anterior sin irrigación.
fig 9: se observa (de perfil) la onda de crecimiento y desarrollo de las capas de la retina, y con una línea roja el crecimiento de los vasos retinianos.
• Factores coadyuvantes
Hipoxia severa o paro respiratorios: mayor posibilidades de ROP

Fig 10: reanimación cardiopulmonar de un bebé en paro.
Ductus y problemas cardiacos: empeora el cuadro de ROP.
Uso de surfactante: Perfectamente comprobado que el uso de surfactante disminuye las posibilidades de ROP
Lumino terapia : Ya se demostró que no hay una relación entre la lumino terapia y la progresión de la enfermedad
Fig 11: Luminoterapia neonatal
Dióxido de carbono: su acción vasodilatadora haría aumentar la superficie de
endotelio expuesta a la acción tóxica del oxígeno. Algunos trabajos encuentran una relación entre ROP e hipercapnia,
Indometacina, usada para tratar el ductus persistente: provoca vasoconstricción por alteración en el equilibrio entre prostaglandinas. Tampoco está clara su relación con ROP.
Transfusiones: la Hb F tiene mayor afinidad por el oxígeno que la Hb del adulto, por lo que las transfusiones con sangre o concentrados de hematíes procedentes de donantes adultos hacen aumentar el oxígeno libre circulante en sangre.
Vitamina E: durante algunos años se utilizó para prevenir ROP por su acción antioxidante, sin embargo a las dosis útiles provocaba un aumento en la incidencia de enterocolitis necrotizante. Además, parece ser que disminuye la severidad de ROP pero no su incidencia, por lo que prÁcticamente no se utiliza.
Historia Natural
Se estima que la incidencia de ROP en una población de prematuros de menos de 1500 grs. y/o menor a 30 semanas de gestación va ser entre el 16 al 56 % dependiendo de la terapia neonatal.
La ROP se desarrolla entre las 35 y 45 semanas de edad gestacional.
El primer signo de ROP se puede detectar a las 4 semanas de vida extrauterina.
Casi la totalidad de los niños que desarrollan algún estadio de ROP grados I-II, luego completan su vascularización sin problemas, con una resolución total de la enfermedad.
El signo de regresión del ROP es cuando los vasos continúan su camino superando la línea de demarcación, o sea cuando se vasculariza la zona avascular, evento que puede ocurrir hasta 20 semanas después de que se vieron los primeros signos de la enfermedad.
Un porcentaje pequeño de estos prematuros que tiene ROP puede evolucionar a grados peores, y si no es tratado llegar al desprendimiento de retina y la ceguera.
Fisiopatología
Como se indicó antes, la vasculogénesis normal se inicia en la semana 16 de vida intrauterina mediante un precursor mesenquimal que aparece en el nervio óptico, que va avanzando hacia la periferia, y la alcanza a las 36 a 38 semanas en el lado nasal y a las 40 a 45 semanas en el lado temporal.
El precursor mesenquimal es acompañado en su migración por unas células espiculares que son precursoras de las células endoteliales de los vasos retinianos internos.

Fig 12: desarrollo embriológico del globo ocular
Para el desarrollo vascular hay 2 teorias: angiogenica y vasculogénica
Teoría Vasculogenica: a partir de celulas fusiformes se desarrollan celulas endoteliales que forman cordones sólidos que luego se ahuecan formando los nuevos vasos.
Teoría Angiogenica: a partir de vasos ya existentes se desarrollan brotes que formarian los nuevos vasos.
Las 2 teorias se complementan en el desarrollo normal de la retina
Lo más importante es que la onda de crecimiento vascular sea en forma conjunta con la onda de crecimiento celular de las capas de la retina.
En estas condiciones de normalidad, el límite entre retina vascular y avascular es difuso.
Ante un agente tóxico determinado, que podria ser el O2 (se ha determinado que más de 10 horas de oxigeno inspirado sin control es el responsable de producir un cierre definitivo del los vasos normales), se interrumpe la vasculogénesis, pudiendo permanecer así días o semanas sin cambios.
En el momento en que se reemprende la vasculogénesis, pueden suceder dos cosas:
· que las células del shunt arteriovenoso se diferencien en células endoteliales capilares normales y los capilares avancen sobre la retina avascular, y regresan las anomalías (sucede en más del 90% de los casos)
· que las células del shunt empiecen a multiplicarse de forma indiferenciada, formando un tejido fibrovascular con gran capacidad de formación de colágeno: se forman membranas fibrosas vitreoretinianas que traccionan sobre la retina formando pliegues, desprendimiento de retina y en última instancia, fibroplasia retrolental.
Los factores que determinan si la evolución será en un sentido o en otro son
conocidos, pero no pueden ser bien controlados
Lo que sí está claro es que cuanto más posterior sea la detención de los vasos y mayor extensión de retina sin vasos, peor será el pronóstico. Este concepto es tan importante que condiciona el sistema de clasificación de la ROP.
Desarrollo de la Enfermedad : Retinopatía del Prematuro
Al nacer un bebé prematuro, por su inmadurez pulmonar debe incorporase oxígeno, necesario para su vida y su función cerebral. Como se explicó anteriormente, esto inhibe el estímulo de crecimiento de los vasos retinales, produciendo un “falso estado de normalidad”: hay un desequilibrio entre la cantidad de retina a irrigar y la cantidad de vasos desarrollados.
Esto forma una zona de retina sin vasos (isquémica) y una zona de retina vascularizada. Entre ellos hay una línea que los delimita perfectamente, llamada Línea de Demarcación o grado 1
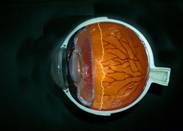


Fig 13: ROP grado 1
Entonces crece la retina pero sin su correspondiente apoyo vascular. Cuando el bebé queda expuesto a su propia respuesta respiratoria (se le quita el apoyo respiratorio), se produce un disbalance entre la necesidad y el aporte de oxígeno del sector de retina que ha madurado (y aumentado así su necesidad de energía) luego de que se detuviera el desarrollo vascular. Ocurre entonces una gran hipoxia retinal, que produce como respuesta liberación de sustancias vasoproliferativas ( VEGF- factor de crecimiento endotelial-, MMPs, etc. ) que llevan a la liberación de proteinas formando un cordon blanquecino llamado Loma o Borde fibrovascular , RIDGE o grado 2
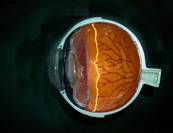

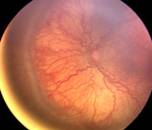
Fig 14: ROP grado 2
Y si continúa el proceso ya hay crecimiento fibrovascular y de nuevos vasos (Neovasos) que crecen desorganizadamente; en vez de ir horizontalmente en la superficie de la retina, toman una dirección vertical hacia el interior del ojo, hacia el Vítreo, formando así el grado 3 o Neovascularización en la Loma.
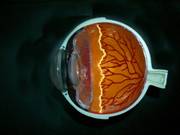

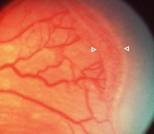
Fig 15: ROP grado 3
En este punto ya hay cortocircuitos arteriovenosos, que producen dilatación venosa y retorno vascular anómalo, lo que se denomina Enfermedad PLUS
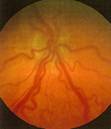
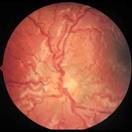
Fig 16: Plus vascular en polo posterior
Puede presentarse en el polo posterior, en los vasos del iris, con hemorragias vítreas, etc.
Si la enfermedad sigue llegamos al desprendimiento de retina
Desprendimiento de retina parcial grado 4 a : no afecta la mácula, y grado 4 b que sí la afecta.
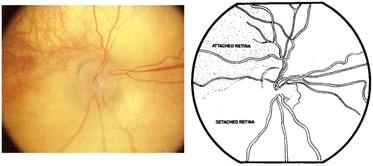
Fig 17: ROP grado 4: desprendimiento de retina parcial
Finalmente se llega al grado 5: Desprendimiento de retina total o Fibroplasia Retrolental, con distintas formas de presentación.
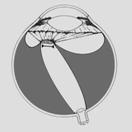
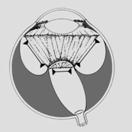
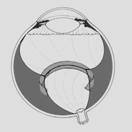
Fig 18: ROP grado 5: desprendimiento de retina total (esquema)
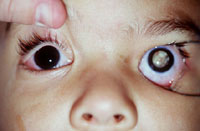
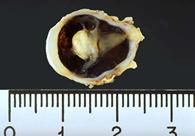
Fig 19: Leucocoria ojo izquierdo; y globo ocular que presenta ROP grado 5 (anatomía patológica)
Clasificación Internacional de ROP
En 1984, en una reunión de veintitrés prestigiosos oftalmólogos de 11 diferentes países se concibió un sistema de clasificación: ICROP, que utilizamos hasta hoy.
Esta clasificación determinó un hito fundamental en el estudio, tratamiento y control del ROP, porque se admitió la enfermedad en todo el mundo y se pudieron clasificar y comparar resultados y casos clínicos de diferentes lados.
Tuvo en cuenta 3 aspectos :
A- LOCALIZACIÓN :
Se dividió el fondo de ojo en 3 zonas circulares:
· Zona I o de Polo Posterior: es un círculo que tiene en su centro la papila óptica, y su radio es igual al doble de la distancia papila – mácula.
· Zona II o Retina Periférica: el radio que la determina va desde donde termina la zona I hasta la Ora Serrata (límite periférico de la retina en el ojo) del lado nasal.
· Zona III o Extrema Periferia: Es una zona de retina periférica temporal en media luna que queda entre la zona II y la Ora Serrata temporal (última zona en vascularizarse).
B- EXTENSION:
Se expresa en horas de reloj que estén ocupados por la enfermedad ROP.
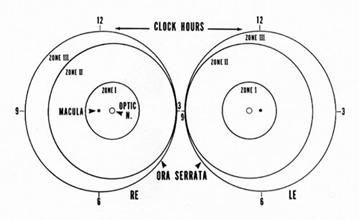
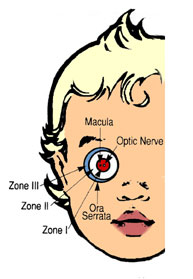
Fig 20: Esquema de ICROP demostrando cómo se describe localización y extensión
C - SEVERIDAD:
Clasifica la enfermedad según estadio evolutivo (severidad) en “Grados”, que son:
0- Vascularización incompleta pero sin ROP
1 - Línea de demarcación
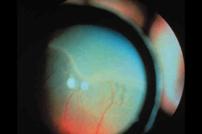
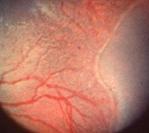
Fig 21: ROP grado 1 (foto clínica)
2 - Loma o Cordón
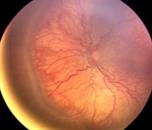
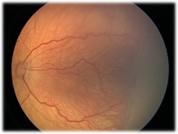
Fig 22: ROP grado 2 (foto clínica)
3 - Proliferación fibrovascular extraretinal
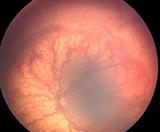
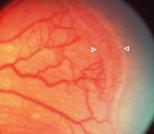
Fig 23: ROP grado 3 (foto clínica)
Cualquier grado puede complicarse con Enfermedad Plus : Incompetencia vascular progresiva, que comprende alguno de los siguientes signos:
Dilatación vascular, tortuosidad vascular
Falta de dilatación pupilar
Hemorragias periféricas en retina
Turbidez vítrea
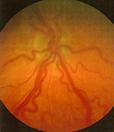
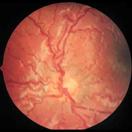
Fig 16: Plus vascular en polo posterior
4-Desprendimiento de retina traccional periférico
4a - Sin llegar a mácula
4b - Involucra mácula
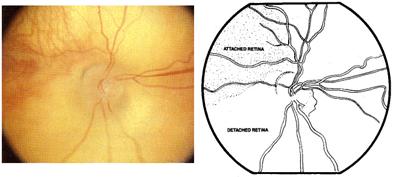
Fig 17: ROP grado 4: desprendimiento de retina parcial
5 - Desprendimiento de retina total (varias formas clínicas : Tubo abierto, abierto-abierto, cerrado-cerrado, cerrado-abierto, cerrado)

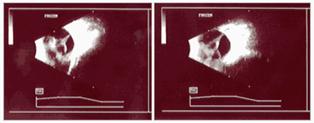
Fig 24: Leucocoria ojo izquierdo , Ecografía de ROP grado 5.
Hoy se habla de dos etapas en la evolución de la Enfermedad ROP :
| 1.Fase de Actividad : ROP Agudo |
Grados 1, 2, y 3 Enfermedad Plus Rush Disease |
Hay un momento de la enfermedad que es crucial y es llamado “Umbral de tratamiento”: Grado 3 con 5 horas de reloj continua o 8 horas discontinuas, más enfermedad plus. Aquí el estudio colaborativo Cryo-Rop demostró que el 50%, de los niños librados a su evolución desarrollaban desprendimiento de retina y ceguera. Es el momento en que aplicando el tratamiento adecuado se disminuyen enormemente estas malas evoluciones.
| 2.Fase de Inactividad : ROP Cicatrizal |
Grados 4ª, 4b, y 5 Secuelas de Regresión |
Secuelas de Regresión: la mayoría de los niños tiene una regresión espontánea: los vasos retinianos cruzan la zona de stop previo, y terminan con normalidad la irrigación de la retina.
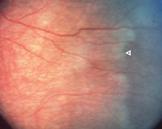
Fig 25: vaso sanguíneo cruzando línea de enfermedad ROP (flecha blanca)
Pero también se puede completar con algún signo de alteración, como tracciones y deformaciones de retina.
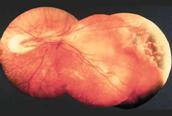
Fig 26: tracción papilar nasal post-tratamiento con Crio
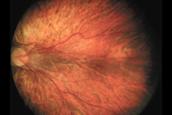
Fig 27: Ectopia macular por tracción retinal temporal
Las secuelas retinianas que deja el ROP en regresión dependen del estadio que haya alcanzado en la fase aguda .
Los bebes prematuros pueden sufrir, a lo largo de su vida, más comúnmente de : miopía, astigmatismo, estrabismo, visión subnormal, pliegues retinianos, tracción macular, papila inclinada, microftalmos, glaucomas incontrolables, DR tardíos.
Examen del Recién Nacido Prematuro
Se debe realizar examen oftalmológico con oftalmoscopia binocular indirecto (OBI) a todo niño prematuro, en la Unidad de Terapia Intensiva Neonatal a las 4 SEMANAS DE NACIDO.
Debe realizarse con pupila dilatada. Para esto hay que dilatar las pupilas del bebe con Fotorretin, 1 gota cada 15 minutos 3 a 4 veces.
El Fondo de ojo se realiza con Oftalmoscopio binocular indirecto ; con anestésicos tópicos, y con separador de párpados tipo mosquito o de prematuros.
Hay que revisar polo posterior y la periferia del globo ocular, con indentación, revisar los 360 grados de la retina. Es importante identificar la presencia de grandes bahías en la zona temporal .
¿ Qué Niños se deben revisar ?
Para utilizar los mismos criterios en todas las Unidades de Cuidados Neonatales en nuestra provincia, realizamos en forma conjunta el “Protocolo de estudio de Retinopatía del Prematuro en San Juan”, que acordó:
Estudiar a todos los prematuros nacidos con :
-Menos de 33 semanas y/o 1500 gr ;
- Menos de 35 semanas y/o 2000 gr que hubieran recibido oxígeno ;
- Todos aquellos hipoxiados graves (Apgar 0 a 3 en el primer minuto y/o hasta 5 a los 5 minutos) ;
- Aquellos con curso clínico inestable ;
- Gemelar de alguno con estas características.
El examen se realizará en la Sala de Neonatología al principio, por observadores participantes en este grupo de trabajo, con oftalmoscopio binocular indirecto e indentación escleral.
El Primer examen se realizará a las cuatro semanas de nacido, y el Seguimiento será : en grado 0 a 1 : cada 2 semanas ; en grado 2 : cada 1 semana ; en grado 3 : cada 72 horas. En todos los casos para esquema de seguimiento se aplicará el criterio del observador dependiendo también de la localización de la enfermedad y la edad corregida del paciente ; al alta de la Neonatología los controles continuarán por consultorio externo. Este incluirá examen hasta al año de vida para descartar secuelas, incluyendo errores de refracción, estrabismo,etc
Tratamiento
En el Protocolo antes nombrado se estableció que: el tratamiento (Fotocoagulación con diodo láser por oftalmoscopio binocular indirecto en zona anterior a la enfermedad) se indicará según los siguientes criterios : Enfermedad grado 3+ en zona 2, de 5 horas de extensión continuas u 8 discontinuas ; o cualquier grado en zona 1 con plus. Se tendrá en cuenta también la edad corregida y la localización de la enfermedad al indicar o no tratamiento.
Se realizará bajo anestesia local, tópica, bajo sedación, o general inhalatoria, según lo indique el médico, en Neonatología o en quirófano central, bajo control del equipo de anestesia y de neonatología .
Lo que se busca es ya sea con Criocoagulación o con Fotocoagulación con láser por OBI ablacionar la zona de retina avascular anterior cuando se alcanzó el “umbral de tratamiento”.
Hay que ubicar el tratamiento sobre la retina periférica sin irrigación, isquémica.
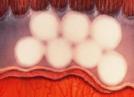
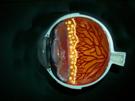
Fig 28: Tratamiento localizado sobre retina avascular
El resultado del tratamiento puede evaluarse desde el 5° al 7° día, y los signos de una respuesta favorable son : la disminución del plus, y más tarde, el cruce de los vasos sobre el borde de separación entre la retina isquémica y no isquémica,
Si no observamos estos signos positivos en su evolución, podemos repetir el tratamiento.
En los casos en que la fotocoagulación (o criocoagulación) no se logra alcanzar el resultado esperado, o en los que por distintos motivos (por ejemplo mal estado del bebé que impidió que el mismo se realizara) se llega “tarde” al mismo, se recurre a la Cirugía.
Se utiliza en los grados IV y V , intentando conseguir, por lo menos, algo de visión.
Hay 2 tipos de cirugía :
Cerclaje escleral :
Es un método muy bueno que se realiza sin la apertura del globo ocular, y que busca disminuír la tracción anterior de la proliferación fibrosa.
Consiste en colocar una banda de silicona de 2 mm de ancho alrededor del globo ocular , pasando por debajo de los músculos rectos.
Lo usamos en el grado 4b o en los caso sin respuesta al tratamiento.
El cerclaje debe ser cortado entre los 6 meses y el año de vida porque al comprimir el globo ocular, en su crecimiento normal, produce altas miopías, siendo éste su mayor inconveniente.
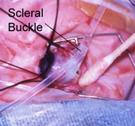
Fig 29: colocación de cerclaje escleral
Cirugía Vítreo-retinal.
Se realiza en el grado 5 y preferiblemente en el caso de tubo abierto - abierto o abierto - cerrado
La cirugía vitreo-retinal es muy difícil de realizar por el tamaño y la forma del globo ocular del prematuro, su enorme respuesta inflamatoria, sus complicaciones postoperatorias y la dificultad de controlar al bebé. Además los resultados son bastante desalentadores, ya que un alto porcentaje, entre el 60 y el 80 %, van a la ceguera, y sólo algunos casos terminan con un remanente de visión
En el caso de los tubos cerrados - abiertos o cerrados - cerrados es preferible no realizar cirugía.
ROPARD Association for Retinopathy of Prematurity and Related Retinal Diseases http://www.ropard.org/
Retinopathy of Prematurity : http://www.konnections.com/eyedoc/ropstart.html
ROP support group http://www.konnections.com/eyedoc/ropsupp.html
ROP : http://www.growingstrong.org/rop
ROP Links http://www.growingstrong.org/rop/roplinks.html
ROP - D. Derleth http://hometown.aol.com/dderleth/ropinfo.html
ROP -Resources at Family Village http://www.familyvillage.wisc.edu/lib_rofp.htm
Visual Impairments – Resources at Family Village
